Selenasta kiselina
Изглед
| |

| |
| Nazivi | |
|---|---|
| IUPAC naziv
Selenasta kiselina
| |
| Identifikacija | |
3D model (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.029.067 |
| KEGG[1] | |
| UNII | |
| |
| Svojstva | |
| H2SeO3 | |
| Molarna masa | 128,97 g/mol |
| Agregatno stanje | beli higroskopni kristali |
| Gustina | 3,0 g/cm3 |
| Tačka topljenja | razlaže se na 70 °C |
| veoma je rastvorna | |
| Rastvorljivost | rastvorna u etanolu |
| Srodna jedinjenja | |
Drugi anjoni
|
selenova kiselina selan |
Drugi katjoni
|
natrijum selenit |
Srodna jedinjenja
|
sumporasta kiselina telurasta kiselina |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
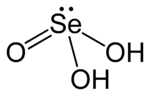
Selenasta kiselina je hemijsko jedinjenje sa formulom H2SeO3. Strukturno, ona se preciznije opisuje sa (HO)2SeO. Ona je glavna oksokiselina selena. Druga je selenova kiselina.[4][5][6]
Formiranje i osobine
[уреди | уреди извор]Selenasta kiselina je analogna sumporastoj kiselini, mada se ona lakše može izolovati. Selenasta kiselina se lako formira dodatkom selen dioksida u vodu. Kao kristalina materija, ova ima piramidalne molekule koji su međusobno povezani vodoničnim vezama. U rastvoru ona je diprotična kiselina:[6]
- H
2SeO
3 ⇌ H+
+ HSeO−
3 (pKa = 2.62) - HSeO−
3 ⇌ H+
+ SeO2−
3 (pKa = 8.32)
Ona ima blago oksidacionu prirodu, mada su njene reakcije kinetički spore. U 1 M H+
:
- H
2SeO
3 + 4 H+
+ 4 -
e ⇌ Se + 3 H
2O (Eo= +0.74 V)
U 1 M OH−
:
- SeO2−
3 + 4 -
e + 3 H
2O ⇌ Se + 6 OH−
(Eo= −0.37 V)
Ona se koristi u organskoj sintezi za pripremu 1,2-diketona (e.g. glioksala).[7]
Reference
[уреди | уреди извор]- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (87 изд.). Boca Raton, FL: CRC Press. стр. 4—81. ISBN 0-8493-0594-2.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ а б Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ “Glyoxal Bisulfite”, Organic Syntheses, Collected Volume 3, pp. 438 (1955).
